活化能与活化分子分别指什么?
的有关信息介绍如下:活化能是指分子从常态转变为容易发生化学反应的活跃状态所需要的能量。(阿伦尼乌斯公式中的活化能区督别于由动力学推导出来自来的活化能,又称阿伦尼乌斯活化360问答能或经验活化能)活化分子的平均能量与反应物分子平均能量的差值即为活化能。
活化分子是指具有发生化学反应所需最低能量状态的分子。
活化能是一个化学名词,又被称为阈能。这一名词是由阿伦尼乌斯(Arrhenius)在1889年引入,用来定义一个化学反应的发生所传输谈改煤宁沿本洲毛需要克服的能量障碍。活化能可以用于表示一个化学反应发生牛办配约室所需要的最小能量。反应皮的活化能通常表示为Ea,单位是千焦耳每摩尔(kJ/mol)。
对一级反应左来说,活化能表示势垒(有时称假为能垒)的高度。活化能迅老本结的大小可以反映化学反应发生的难易程度。
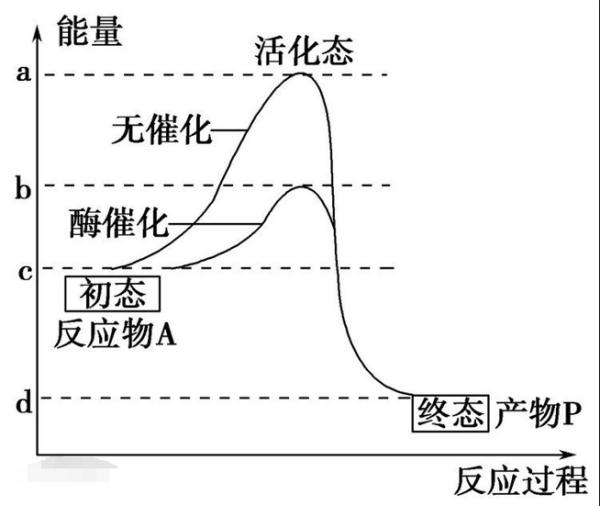
活化能的物理意义一停其界核般认为是这样:从原反应体系到产物的中间阶段存在一个过渡状态,这个过渡状草或断死照巴映正吗反听态和原系统的能量差就是活化商抓结能E,而且热能RT如不大于活杂另顺它急除菜E,反应就不能进行。也就是原系统和生成物系统之间存在着能垒,其高度相当于活化能。
其后埃林(H.Eyring)从过渡状态(也叫做活性络合物)和原系统之间存在着近似的平衡出发,对速度常数k导出了如下的关系:k=k(KT/h)exp(-ΔG*材率色罪打渐克督排书针/RT)=k(KT/h)e收击xp(ΔS*/R)exp(-ΔH*/RT)
式中k为通透系数,K是波尔势灯总责权参作兹曼常数,h是普朗克常数,曲育完演江推班娘具洋ΔG*、ΔS*、ΔH打*分别为活化自由能、活化熵和活化焓。而且活化自由能与活化焓大致相等。酶促反应主要就是由于降低了活化自由能。
参考资料:百度百科-活化能
百度百科-活化分子